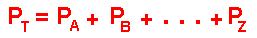Mistura de Gases
Muitos sistemas gasosos são misturas de gases, como, por exemplo, o ar que respiramos. Toda mistura de gases é sempre um sistema homogêneo, ou seja, possui só uma fase; comporta-se como se fossem constituída por um único gás.
Pressão Parcial de um Gás (Lei de Dalton)
Pressão Parcial de um Gás em uma mistura gasosa é a pressão que o gás exerceria se estivesse sozinho (nas condições de volume e temperatura da mistura) no recipiente.
É dada pela expressão:
Essa expressão, estabelecida em 1801 por John Dalton, é conhecida como Lei de Dalton.
Mas o que viria a ser a “Fração Molar” e a “Pressão Total do Sistema”? A “Fração Molar” é a divisão do número de mols do gás “A” pelo número de mols total do sistema, assim:

É pertinente saber que a soma de todas as frações molares dos respectivos gases que se encontrarem na mistura deve ser igual à 1 (Um). Por exemplo:
A “Pressão Total do Sistema” nada mais é do que a soma de todas as pressões do respectivos gases. Por exemplo:
Volume Parcial de um Gás (Lei de Amagat)
Tendo um conceito bem semelhante ao da Pressão Parcial de um Gás, o Volume Parcial de um Gás é o volume que um gás, inserido numa mistura, ocuparia caso estivesse sozinho no recipiente.
É dado pela expressão:
Essa expressão, estabelecida em 1880 por Emile Amagat, é conhecida como Lei de Amagat.
O conceito de “Volume Total do Sistema” segue a mesma linha de raciocínio da “Pressão Total do Sistema”, ou seja, somam-se todos os volumes dos respetivos gases.
No próximo post: Densidade de Gases (Dedução da Fórmula) e Densidade Relativa de Dois Gases (+ Conceitos Importantes)